突出现代癌症研究的主要趋势
近些年来,随着研究的深入,科学家们在揭示癌症发生机制及耐药的新型通路上取得了突破性的成果,同时科学家也开发出了多种抵御癌症的新型疗法及预防措施,比如我们所熟知的癌症化疗法、放疗法,以及癌症免疫疗法等方法。
而如何靶向杀灭癌细胞呢?科学家们有着不同的方法。近日,发表在国际杂志Cancer Cell上的一项研究论文中,来自卑尔根大学等机构的研究人员发现了一种可以帮助癌细胞扩散的特殊蛋白,那么科学家们就找到了癌细胞的致命要害,通过抑制这种特殊蛋白的活性或许就可以抑制癌症扩散,进而杀灭癌细胞。
那么科学家们还有什么高大上的杀灭癌细胞的方法呢?请随小编一一来学习。
【1】漂亮!新型纳米材料定向爆破癌细胞
原文链接(15 February 2016 doi:10.1038/nnano.2015.343 )
对于那些体内已经存在肿瘤的患者,一般会通过手术切除肿瘤。通常在术后,为了巩固手术效果,医生还会根据患者的情况为患者安排化疗或者放疗。但是这种疗法对人体来说会有很大的毒副作用,比较常见的会有脱发、恶心呕吐、食欲不振和白细胞或血小板减少等等,让患者痛不欲生。
美国德州的莱斯大学(Rice University)的一个研究团队决定使用纳米金属粒子来解决这个问题。
研究人员首先利用细胞免疫疗法的原理,找到癌细胞表面的特殊标志物,然后找到相对应的免疫蛋白抗体,将其结合到纳米金属颗粒上,这样的纳米金属颗粒就像长了眼睛一样,专挑癌细胞表面聚集。
由于第一步的精巧设计,大量的纳米金属颗粒会成簇的聚集在癌细胞表面,然后被癌细胞成簇的吞下,而健康细胞里面几乎没有纳米金属颗粒。所以这回只需要使用超短波红外线脉冲即可加热纳米金属颗粒“烫死”癌细胞了。然而,没想到的是,Lapotko团队的这一设计让他们收获了意外的惊喜。这回癌细胞不是被“烫死”的,是被“炸死”的!癌细胞被精准爆破。
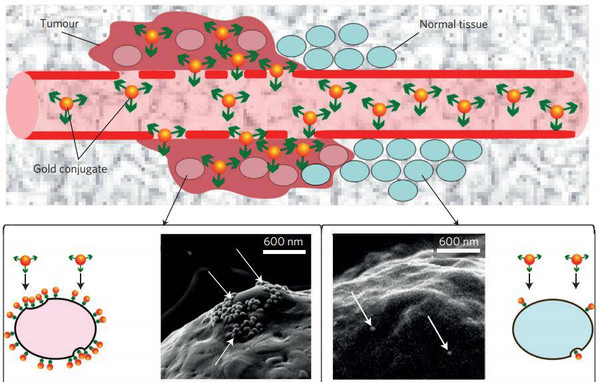
(上)橙黄色的纳米金属颗粒带着绿色的抗体蛋白穿梭于血管和肿瘤组织中;(下)大量长了“眼睛”的纳米金属颗粒聚集在左边的癌细胞表面,也有少量“眼瞎”的聚集在右边的健康细胞表面(Lukianova-Hleb EY,2016,Nat Nano)
【2】阿喀琉斯之踵-GPS定位癌细胞
伦敦大学学院(UCL)的研究人员已经发现了一种寻找癌细胞的新方法:人体可以寻找肿瘤中的特殊标记来确定肿瘤的位置。它有一个神奇的名字——“阿喀琉斯之踵”。
以前,科学家们试图用相同的原理引导免疫系统,来消灭恶性肿瘤,但是这些疗法不太管用,并且让人体的防御机制走向了错误的方向。
癌细胞的不同是导致这一现象的部分原因。
实际上,癌细胞经过了极端的突变。这种情况就像是树的“主干”发生了变异,在接下来的细胞复制中又产生了不同的变异,这就是癌细胞的异质性。针对这一现象,新的研究发现了一种寻找“主干”变异的方法,它可以改变抗原,即癌细胞表面嵌入的蛋白质。
定位主干变异细胞有两种方法。
第一种方法是为每个病人开发癌症疫苗,训练免疫系统定位癌细胞。
第二种方法是”钓出“已经可以定位变异细胞的免疫细胞,在实验室中培养增殖,然后再放回病人的体内。
癌症研究院的马尔科 格林杰博士(Marco Gerlinger)说这项工作非常有趣,但是它的实际运作情况还有待考证。”
【3】32岁科学家发明血液癌细胞透析技术,真是神了!
今年《麻省理工学院技术评论》评选出的亚洲35位35岁以下科技创新精英(TR35)中,有一位叫Majid Ebrahimi Warkiani获奖者,他研发的新技术将为癌症的诊断和治疗带来新的希望。
Warkiani今年32岁,目前是澳大利亚世界顶尖研究型学府新南威尔士大学(UNSW)的助理教授,他还是UNSW纳米医学中心的项目负责人。
Warkiani的新技术叫“透析癌症”(dialysis for cancer),利用这一技术不仅可以发现早期的癌症,评价癌症的治疗效果,以及对癌症的发展做出判断(即所谓的预后);更重要的是,这项技术还有治疗的作用。这种治疗方法简单易懂,就是直接滤掉血液中的癌细胞,延缓甚至阻止癌症的扩散转移。
一直以来,癌症死亡率居高不下的最主要原因就是癌症的扩散转移。当癌组织成长到一定的程度时,癌细胞会进入癌组织中的血管,成为循环肿瘤细胞(CTCs),这些CTC在寻找到合适的新居所之后,便进入该组织定居。这就是为什么很多人最开始得的是胃癌,最后变成肝癌、肺癌、骨癌,甚至脑癌。实际上目前的放化疗手段也仅仅是将体内的癌细胞控制在一个较低的水平,并不能彻底清除体内的癌细胞。而据Warkiani介绍,“透析癌症”技术可以除掉血液中95%的癌细胞。表明该技术在提高癌症治疗质量,抑制癌症转移方面有巨大应用价值。
【4】JRO:自杀式基因疗法杀死前列腺癌细胞
原文链接(DOI: 10.1007/s13566-015-0239-y)
来自美国休斯顿卫理公会医院的研究人员进行了一项长期临床研究,研究结果表明放射治疗结合"自杀基因治疗"技术可以为前列腺癌病人提供安全有效的治疗。"自杀式基因治疗"技术通过对前列腺癌细胞进行基因修饰使得癌细胞向病人免疫系统发送信号实现"自杀"过程。相关研究结果发表在国际学术期刊Journal of Radiation Oncology上。
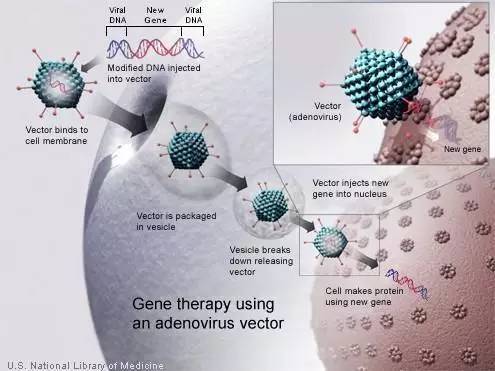
文章作者E. Brian Butler说道:"我们使用腺病毒携带能够产生胸苷激酶(TK)的疱疹病毒基因,直接靶向到肿瘤细胞,一旦基因完成导入就会开始合成TK,在此之后,我们给病人服用一种常用的抗疱疹药物--伐昔洛韦,这样就能够攻击疱疹病毒DNA,使合成TK的肿瘤细胞发生自我摧毁,所以我们把这项技术称作'自杀式基因疗法'。"
Butler表示,一旦伐昔洛韦开始攻击肿瘤细胞,它就会唤起病人的免疫系统,对癌细胞发起总攻。
根据这项研究的结果,将基因疗法与放射治疗结合使用,无论是否进行激素治疗,都非常具有应用前景。除此之外,使用联合治疗方法的病人各项参数均好于单独使用放射治疗的病人,研究人员表示,大部分参与研究的病人基本没有出现副作用,目前III期临床试验正在进行,在得到FDA批准之前仍然需要对该方法的安全性和有效性进行进一步评估。
【5】新研究用热激活“手榴弹”定点摧毁癌细胞
新闻报道:Heat-activated 'grenade' to target cancer
来自曼彻斯特大学的研究人员之前开发出小的膜泡样脂质体可以用来装载癌症治疗药物并将药物转运到癌细胞内,但是与其他治疗方法所面临的问题相同,如何将脂质体直接导向到肿瘤进行药物投递同时不影响健康组织是这一技术所面临的重要挑战。

最近这两项新研究表明在脂质体上装备热激活触发元件能够部分解决上述问题。研究人员在实验室内对小鼠模型体内的肿瘤进行轻微加热,通过这种方式拉开了"手榴弹"的拉环,实现了对癌细胞杀伤药物的释放并达到靶向癌细胞的目的。
Kostas Kostarelos教授指出,他们将热触发温度设为42摄氏度,比正常体温高几度。虽然这项工作目前只在实验室内得到验证,但研究人员表示目前已经有一些可以根据不同的肿瘤类型对病人体内的癌细胞进行加热的方式,并且其中一些方法已经得到了临床应用。
【6】Molecular cell:切断癌细胞备用能源 “饿”死癌细胞
原文链接(doi:10.1016/j.molcel.2015.08.013)
癌细胞的代谢过程与正常细胞有很大不同。细胞的快速增殖意味着癌细胞对能量的需求会显著增加,而葡萄糖是癌细胞的主要营养来源,它们对葡萄糖的利用速率是正常细胞的几十倍甚至几百倍。但当葡萄糖变得缺乏,癌细胞就必须转而使用备用营养物质以维持细胞生长和存活。
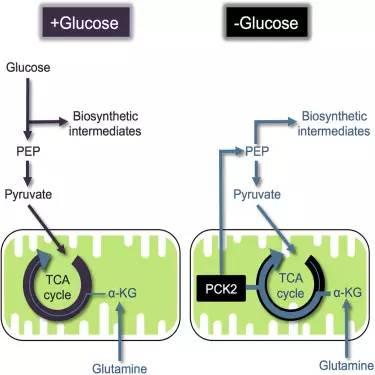
科学家们对葡萄糖供应减少情况下非小细胞肺癌细胞的应答情况进行了研究,结果发现一些肺癌细胞会在葡萄糖缺乏情况下转变它们对"食物"的偏好,转而使用谷氨酰胺。
研究人员发现癌细胞会通过一种叫做PEPCK的酶对癌细胞代谢进行重编程。他们发现癌细胞会表达PEPCK,帮助它们将谷氨酰胺转变成能量以及各种生物合成过程所需的原料以维持细胞生长。通过这一改变,癌细胞不仅能够保持存活,还可以在饥饿情况下继续保持增殖。
这种出色的灵活性可能也是癌症如此致命的一个重要原因,但研究人员同时表示这也为找寻新的癌症治疗方法提供了希望。
【7】Nat Commun:微型植入物成功捕获癌细胞
原文链接(doi:10.1038/ncomms9094)
细胞会随着原始的肿瘤位点而移动进而侵袭其它器官,癌细胞的这一过程被称之为癌症转移,癌症转移往往是在患者晚期阶段被发现,从而导致患者死亡。

而在血液中对循环肿瘤细胞(CTCs)的早期检测或可帮助加速癌症的诊断及疗法的开发;但游动的癌细胞会以很小的数量在机体中“旅游”,而且持续时间较长在其找到新的侵袭位点之前其非常难以发现。
研究者开发了一种大约0.5厘米宽的生物可降解的圆盘,并且对每个小鼠进行植入。这种植入物会利用免疫细胞作为诱饵,同时它还包含有一种扫描仪可以检测到捕获的癌细胞的存在。
研究者指出,这种结合系统就可以实现对转移性疾病的检测,而且可以在癌症扩散之前对患者疾病进行检测,从而就可以帮助患者制定出有效的治疗策略来遏制疾病发展,延长患者生命。随后植入物就可以对捕获的转移性癌细胞进行分析,以帮助制定最优的疗法。
【8】Cancer Cell:治疗新潜力药物—让癌细胞“得瑟”而死
原文链接(DOI:10.1016/j.ccell.2015.07.005)
癌细胞的分裂繁殖速度已经超乎正常,那如果给点刺激,让癌症细胞长得再快点会出现什么情况?——答案是会“得瑟”而死。
肿瘤细胞需要获得癌基因突变,以支持它们的生长和生存。大量的研究都集中在识别致癌基因,作为癌症药物靶标。致癌基因中,类固醇受体共激活因子(SRC)家族成员尤其具有作为治疗靶标的希望,因为这些蛋白质坐落在使癌细胞快速增长、扩散、并获得耐药性的关键信号传导途径中。在之前的研究中,Lonard和另一位同事Bert O'Malley通过筛选大量的化合物,在动物模型中确定了一种SRC抑制分子,能杀死多种癌细胞,抑制肿瘤生长。这些化合物是类似于常规的抑制癌基因的药物。但是,他们有一个违反直觉的想法:如果他们能破坏关键信号通路,过度刺激SRC,会不会杀死癌细胞?毕竟癌细胞在很大程度上依赖SRC精细调节各种细胞活动,所以SRC刺激可能与SRC抑制在扰乱癌细胞信号活性的平衡一样有效。
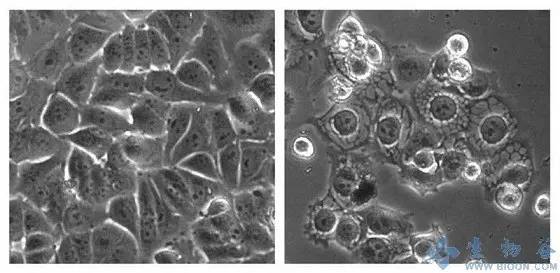
图:左为对照组癌细胞,右为经MCB-613处理的癌细胞
为了验证这个想法,他们筛选成千上万的化合物,以确定一个有效的SRC激活物——被称为MCB-613。MCB-613能杀死人乳腺癌、前列腺癌、肺癌和肝癌细胞,同时保留正常细胞。当研究人员向13只乳腺癌小鼠注射MCB-613后,这个化合物几乎完全消除了肿瘤的生长,同时没有引起毒性,而对照组的14只小鼠肿瘤在7周内长到了原来的3倍以上大小。
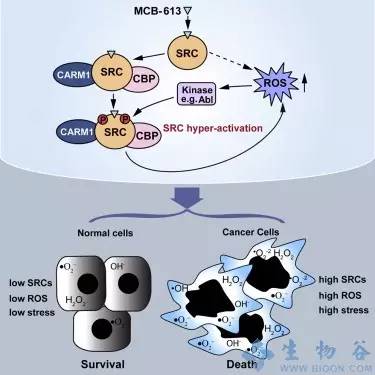
那具体的工作机制是什么?MCB-613使内质网上的未折叠蛋白质大量堆积。因为要支持细胞迅速繁殖,癌细胞必须合成大量的蛋白质,使负责折叠蛋白的内质网承受沉重的工作量。当过度刺激SRC后,给已经达到最大工作量的ER再添额外负担,造成了大量未折叠蛋白的积累,触发细胞的应激反应,导致毒性分子活性氧的增多。
【9】Adv Mat:纳米微球高效高剂量狙杀癌细胞
原文链接(doi:10.1002/adma.201501803)
来自加尼弗尼亚大学的研究人员通过研究开发了一种新型的纳米粒子,其可以在一类特殊蛋白存在的情况下释放药物发挥作用,而特殊蛋白则可以驱动癌症发生转移;文章中研究者开发了一种药物运输系统,其可以有效抑制癌症的发展。
研究者Cassandra Callmann说道,我们以一种小型分子为基础构建了纳米尺度的载体,其可以找到肿瘤并且释放所装载的药物;而这种药物运输系统可以利用一种名为基质金属蛋白酶(MMPs)的特殊酶类蛋白,这种特殊的酶类蛋白在多种癌症中都非常丰富,MMPs可以“撕裂”细胞膜,使得癌细胞可以逃脱而进入机体其他部位引发癌症转移。
研究者开发了一种小型的装载抗癌药物紫杉酚的微型球状结构,并且覆盖以肽类外壳,MMPs可以撕开外壳释放其中所装载的药物,外壳碎片可以形成一种漏网,其就可以包裹药物使其对肿瘤进行稳定地作用。研究者表示,这项研究对于后期开发癌症诊断以及治疗的新型策略非常重要,为了将药物包裹如微型球体结构中,研究者进行了一定的化学处理,事实证明一系列原子对于药物分子的作用效力非常必要,而这也意味着癌症药物在达到肿瘤之前,在其流经的循环系统中是处于失活状态的,这也就避免了药物副作用的发生。
【10】ACSBSE:化疗药物包被或可增强纳米颗粒杀灭癌细胞的效力
原文链接(doi:10.1021/acsbiomaterials.5b00111)
文章中研究者将水凝胶沉积于作用肿瘤的纳米壳上,并且以化疗药物涂层覆盖,Jennifer West教授说道,我们的思路是将破坏肿瘤的热疗法同局部药物运输相结合,这种组合拳或是最有效的癌症治疗手段,研究表明许多化疗药物都可以有效作用于发热的组织上,因此将上述两种方法结合或许存在一定的可能性。
目前光热疗法已经应用于临床试验中进行多种癌症的治疗,纳米壳可以吸收近红外线,近红外线就可以无损伤性地穿过水和组织,然而纳米壳可以快速加热足以杀灭细胞,但其仅会在光照射的地方才会发挥作用。除了精准地靶向作用机体的特殊部位外,这种疗法还会促进纳米壳在肿瘤内部积累发挥作用。
这项研究中,研究人员用特殊的化疗药物覆盖纳米壳,同时在实验室条件下将其运输至肿瘤细胞中,随后疗法就会按照计划开始发挥作用,即纳米壳开始加热,在释放药物的同时破坏大多数的癌细胞;当然完全清除所有的癌变细胞非常重要,因为任何单一癌细胞的逃脱都有可能引发致死性的癌转移。
下一步研究者将利用活体动物来进行新型疗法的试验,当然研究者有信心在不久的将来进行人类临床试验。
(注:转载时请注明复诊网)

